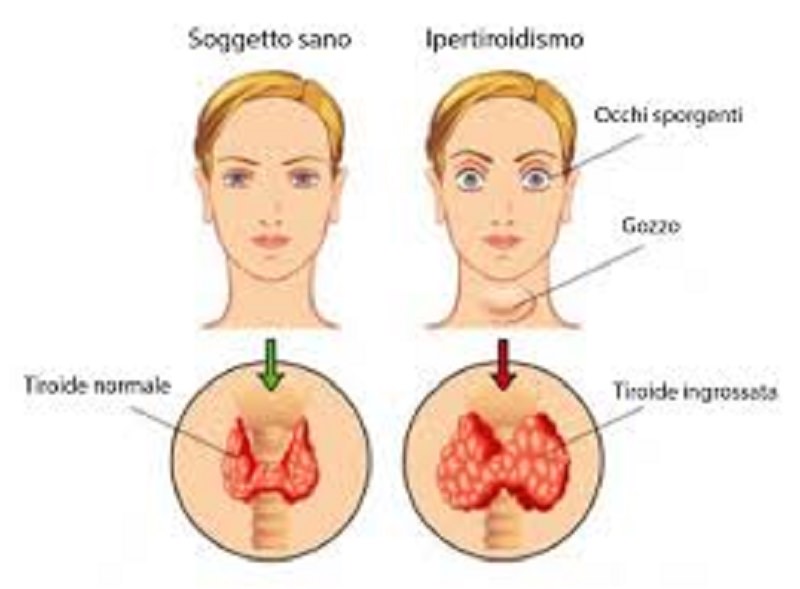
Per ipotiroidismo si intende una sindrome caratterizzata da una riduzione degli ormoni tiroidei nelle cellule bersaglio e clinicamente da una sintomatologia aspecifica e ubiquitaria, contraddistinta da una riduzione delle funzioni di quasi tutti i sistemi, e in particolare quelli cardiovascolare, gastrointestinale e nervoso. In base al periodo di insorgenza è definito congenito o dell’adulto, mentre in base alla sede del deficit è definito primario, quando è causato da insufficienza della ghiandola tiroide, secondario quando il deficit è ipofisario, terziario se ipotalamico ed infine periferico quando è dovuto a deficit recettoriali o post-recettoriali.
In > 90% dei casi l’ipotiroidismo dell’adulto è primario, ovvero da deficit tiroideo. È causato dalla carenza funzionale assoluta o relativa di tessuto tiroideo, essendo sostanzialmente riconducibile alla riduzione quantitativa del parenchima tiroideo attivo o alla compromissione funzionale dello stesso. Le cause principali sono la tiroidite cronica autoimmune, nelle due varianti ipertrofica e atrofica, e quelle iatrogeniche dovute alla somministrazione di radioiodio e/o alla rimozione chirurgica della tiroide.
La tiroidite cronica, come tutte le malattie autoimmuni, si caratterizza per la perdita della tolleranza immunitaria con conseguente reazione immune, umorale e cellulo-mediata, contro autoantigeni. Gli anticorpi sono diretti prevalentemente contro la tireoperossidasi (anti-TPO) e contro la tireoglobulina (anti-Tg). La terapia radiometabolica della tireotossicosi rappresenta una delle cause più frequenti di ipotiroidismo, provocando una riduzione della funzione ghiandolare nel 15-70% dei casi a distanza di 10 anni; la dose radiante e il tempo intercorso dal momento della somministrazione sono fattori che influenzano significativamente l’evoluzione verso l’ipotiroidismo. Il rischio cumulativo di sviluppare ipotiroidismo primario a seguito della terapia radiometabolica è maggiore in caso di malattia di Basedow-Graves che non di gozzo nodulare iperfunzionante.
La tiroidectomia totale ha come conseguenza ineluttabile la comparsa dell’ipotiroidismo, ma anche la tiroidectomia subtotale, frequentemente utilizzata in passato, e seguita da ipotiroidismo permanente nel 10-60% dei pazienti nel primo anno dopo l’intervento chirurgico; tale percentuale aumenta successivamente dell’1-3% all’anno.
Sia nei pazienti sottoposti a tiroidectomia che in quelli trattati con il radioiodio l’ipotiroidismo è più frequente nei soggetti con positività degli anticorpi anti-tireoperossidasi.
Altre cause di ipotiroidismo primario dell’adulto (IPA) sono la carenza o l’eccesso di iodio e la somministrazione di farmaci (litio, tiouracili, imidazoli, amiodarone, interleuchina-2, interferone-α) e di agenti gozzigeni ambientali e industriali. La carenza iodica è responsabile di gozzo e di ipotiroidismo quando l’apporto iodico è < 50 µg/die. Anche l’eccesso di iodio inorganico, che si realizza quando l’introito giornaliero è > 0.5-1 mg, può inibire la captazione e l’organificazione dello iodio stesso, nonchè la sintesi e la secrezione ormonale; questo evento si verifica soprattutto in presenza di una sottostante tireopatia autoimmune o di una disfunzione latente dell’ormonogenesi tiroidea.
Anche quelle patologie tiroidee a carattere autoimmune o infettivo che generalmente presentano un decorso transitorio, come la tiroidite silente, la tiroidite post-partum e la tiroidite subacuta di de Quervain, in alcuni casi possono esitare nell’ipotiroidismo permanente.
Infine, tra le cause più rare di IPA, le malattie infiltrative a carattere sistemico (emocromatosi, amiloidosi, sclerodermia, lupus eritematoso, mesenchimopatie, cistinosi, sclerosi progressiva sistemica) o preminentemente tiroideo (tiroidite di Riedel) possono esercitare un’azione destruente sul parenchima ghiandolare, con conseguente sviluppo di ipotiroidismo. La terapia radiante esterna nella regione del collo, per il trattamento di patologie quali il linfoma Hodgkin e non-Hodgkin o il carcinoma della laringe, induce ipotiroidismo nel 25-50% dei casi. Una causa rara di ipotiroidismo primario manifesto permanente è l’irradiazione corporea totale, praticata in presenza di leucemia acuta o anemia aplastica, che tuttavia si associa più frequentemente allo sviluppo di ipotiroidismo subclinico, spesso a carattere transitorio. Assai più raramente (frequenza 1:100.000-200.000) l’ipotiroidismo è detto centrale (IC), ovvero secondario a lesione ipofisaria (ipotiroidismo secondario) o ipotalamica (ipotiroidismo terziario).
Il deficit di TRH può essere dovuto ad una ridotta sintesi per distruzione del nucleo paraventricolare, per lesioni soprasellari, per produzione di fattori inibitori da parte dell’ipotalamo, come la somatostatina e la dopamina, o per blocco dei recettori per gli oppioidi. Il deficit di TSH può essere dovuto a riduzione delle cellule TSH-secernenti e ad alterazioni strutturali della molecola del TSH.
In base alla causa organica o genetica sottostante sono state descritte forme familiari e sporadiche. Per quanto riguarda le forme sporadiche, le cause di alterazione del sistema ipotalamo-ipofisario possono essere molteplici: invasive, infartuali, infiltrative, infettive, iatrogeniche, traumatiche, autoimmuni, idiopatiche. I macroadenomi ipofisari rappresentano la causa più frequente (50-60% dei casi), determinando una compressione dell’ipofisi o del peduncolo ipofisario con deficit del circolo portale; l’apoplessia ipofisaria è un’altra causa di ipotiroidismo centrale. Una causa sempre più frequente è quella iatrogenica, dovuta a lesioni dell’area ipotalamo-ipofisaria per interventi chirurgici o radioterapeutici per tumori, come i craniofaringiomi, i glio-mi, i meningiomi; infatti, nel 10% dei pazienti sottoposti a chirurgia e fino al 30% di quelli trattati con radioterapia, si riscontra l’ipotiroidismo centrale.
Anche la somministrazione di alcuni farmaci può determinare l’insorgenza di IC interferendo con il funzionamento dell’asse ipotalamo-ipofisario; tra questi ricordiamo il bexarotene, farmaco anti-neoplastico, e la oxcarbazepina, farmaco antiepilettico. La diagnosi di laboratorio si basa sulla determinazione delle concentrazioni sieriche della FT4 e del TSH. In caso di ipotiroidismo primario si evidenziano aumento del TSH e diminuzione della FT4. Gli anticorpi anti-tireoperossidasi (anti-TPO) e anti-tireoglobulina (anti-Tg) sono presenti nel 90% dei pazienti con tiroidite cronica autoimmune.
Altre indagini opportune a completamento dell’iter diagnostico dell’ipotiroidismo sono l’ecografia tiroidea, che permette di determinare le dimensioni della ghiandola, la presenza di una ecostruttura ipoecogena, che si riscontra tipicamente nelle tireopatie autoimmuni, e/o l’eventuale presenza di noduli, e l’ECG, che mostra bradicardia, bassi voltaggi ed alterazioni della ripolarizzazione ventricolare.
La terapia di prima scelta dell’ipotiroidismo primario è medica e si basa sulla somministrazione di ormoni tiroidei per os a permanenza, al fine di ristabilire e mantenere l’eutiroidismo, normalizzando le concentrazioni sieriche di TSH e di FT4. La L-tiroxina (levotiroxina o L-T4) sodica, isolata dagli estratti tiroidei nel 1914 e sintetizzata nel 1926, costituisce il farmaco di prima scelta. La dose iniziale di L-tiroxina deve essere individualizzata e dipende dalla gravità e dalla durata dell’ipotiroidismo, dal peso, dal sesso e dall’età del paziente, nonché dalla presenza di eventuali patologie concomitanti. Generalmente la dose iniziale è con un basso dosaggio, pari a 25-50 µg/die, aumentando la posologia del farmaco di 25-50 µg ogni 4-6 settimane, fino a raggiungere la dose di mantenimento, stabilita sulla base della risposta clinica e del dosaggio del TSH ematico, da effettuare 4-6 settimane dopo ogni cambiamento della terapia, in modo da consentire l’adattamento ipofisario ai nuovi valori ormonali circolanti.
Non esistono controindicazioni alla terapia tiroidea sostitutiva. La terapia con ormoni tiroidei è priva di effetti collaterali e sono rare le descrizioni di reazioni allergiche agli eccipienti e ai coloranti aggiunti alle compresse. La complicanza più facilmente riscontrata è la tireotossicosi iatrogena, la quale, tuttavia, non è ascrivibile tanto ad un effetto intrinseco del farmaco, quanto alla posologia inadeguata dello stesso.