Se hai un quesito medico, invia la tua domanda a ilmedicorisponde@newsicilia.it e torna a visitare il nostro giornale Domenica mattina!

Sono stato dal mio dentista e mi ha fatto la diagnosi di peri-implantite. Ma precisamente di cosa si tratta? (D.L.)
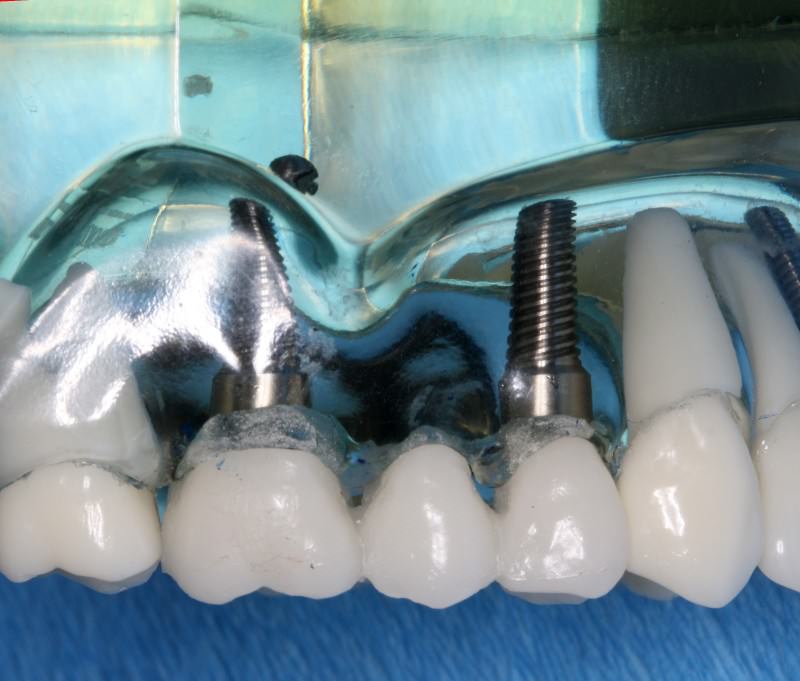
L’impianto dentale rappresenta, ad oggi, la tecnica più all’avanguardia e più efficace sia per le edentulie parziali che per quelle totali. Questa tecnica prevede l’inserimento all’interno dell’osso di un impianto realizzato in titanio che simula la radice dentale, la quale verrà a sua volta connessa ad una struttura protesica sovrastante che andrà a sostituire la corona dentale mancante. Il termine peri-implantite si riferisce ad una infezione causata da batteri parodontali che si manifesta con infiammazione localizzata nei tessuti che circondano gli impianti. Attualmente la perimplantite è la causa più comune di perdita di impianti. Si distinguono due tipi di infiammazione dei tessuti perimplantari: Mucositi: infiammazioni riguardanti solo le mucose che rivestono gli impianti. Se intercettata e trattata in maniera adeguata è un processore versibile. Perimplantiti: infiammazione che interessa sia le mucose, sia l’osso che circonda l’impianto. In questo caso la lesione è visibile radiograficamente. I sintomi sono molto simili a quelli della parodontite: sanguinamento, profondità di sondaggio patologica, presenza di pus, dolore alla percussione e cambiamenti di colore nella gengiva che circonda l‘impianto. In condizioni di salute orale, i tessuti parodontali sono in grado di formare una barriera biologica. I batteri che provocano questo tipo d’infezione sono principalmente batteri anaerobi Gram negativi ed in genere sono gli stessi che provocano la parodontite nei denti naturali. Per questo motivo è indispensabile che prima di apporre impianti, la bocca di un paziente debba essere sana, priva di parodontite, così che i batteri non possano infettare gli stessi impianti. La diagnosi di perimplantite si esegue andando a ricercare quei segni e sintomi di cui abbiamo parlato in precedenza e grazie a test microbiologici che possono dare informazioni complete sui batteri presenti nelle tasche parodontali. Il trattamento della perimplantite prevede una riduzione della carica batterica, attraverso una approfondita igiene professionale effettuata con microscopio operatorio e utilizzo del laser, proprio come per la cura della parodontite. Questo permetterà una decontaminazione batterica e una riduzione dell’infiammazione. È necessario sottolineare, a tal proposito, che l’insuccesso della terapia implantare può essere facilmente previsto dal dentista prima della chirurgia implantare, attraverso un’analisi dei fattori di rischio parodontale. Per ridurre al minimo il rischio di perdita dell’impianto, con una conseguente perdita in termini sia biologici che economici, è fondamentale che la bocca in cui sarà inserito l’impianto sia sana e priva di focolai di batteri parodontali. La diagnosi di perimplantite si esegue andando a ricercare quei segni e sintomi di cui abbiamo parlato in precedenza e grazie a test microbiologici che possono dare informazioni complete sui batteri presenti nelle tasche parodontali. Il trattamento della peri-implantite prevede una riduzione della carica batterica, attraverso una approfondita igiene professionale effettuata tramite ultrasuoni o ancora meglio con microscopio operatorio e utilizzo del laser, proprio come per la cura della parodontite. Questo permetterà una decontaminazione batterica e una riduzione dell’infiammazione. È necessario sottolineare, a tal proposito, che l’insuccesso della terapia implantare può essere facilmente previsto dal dentista prima della chirurgia implantare, attraverso un’analisi dei fattori di rischio parodontale. Per ridurre al minimo il rischio di perdita dell’impianto, con una conseguente perdita in termini sia biologici che economici, è fondamentale che la bocca in cui sarà inserito l’impianto sia sana e priva di focolai di batteri parodontali.
Da circa sei mesi sono in trattamento con statine per ipercolesterolemia ed ho dolori muscolari continui. Mi devo preoccupare per questo effetto collaterale? (A.M.)
Le statine (inibitori dell’HMG-CoA reduttasi) rappresentano oggi la principale terapia per il trattamento delle ipercolesterolemie. La somministrazione di statine è stata associata raramente ad effetti avversi gravi. Sono invece eventi piuttosto comuni le reazioni avverse lievi o le alterazioni di alcuni parametri di laboratorio. Si tratta comunque di effetti autolimitanti che generalmente non richiedono una definitiva sospensione della terapia. Tra questi sono compresi proprio i disturbi muscolari che rappresentano tra gli effetti avversi quelli più comuni e potenzialmente pericolosi. Questi disturbi muscolari variano da dolore o debolezza muscolare fino alla rabdomiolisi. Nell’agosto 2001, la cerivastatina venne ritirata dal commercio perchè associata ad un’incidenza di rabdomiolisi fatale superiore a 3 casi su un milione di prescrizioni. La fisiopatologia alla base dei disordini muscolari da statine non è stata ancora ben chiarita ed è soggetta a numerosi dibattiti nella letteratura medico-scientifica. Appare chiaro comunque che queste complicazioni sono dose dipendenti e spesso associate a numerosi fattori predisponenti. L’American College of Cardiology (ACC), l’American Heart Association (AHA) ed il National Heart Lung and Blood Institute (NHLBI), hanno identificato tre tipi di miopatia da statine: -mialgia: dolore o debolezza muscolare senza incremento dei livelli di CPK; -miosite: dolore o debolezza muscolare con incremento dei livelli di CPK, -rabdomiolisi: disturbi muscolari con incremento dei livelli di CPK 10 volte più elevati rispetto al limite superiore e associati generalmente a mioglobinuria. Queste complicazioni possono insorgere rapidamente dopo l’inizio della terapia oppure possono manifestarsi dopo diversi mesi. In base ai dati disponibili, l’incidenza di miopatia grave da statine appare inferiore ad 1/1000 e quella di rabdomiolisi fatale inferiore a 1/1.000.000 di prescrizioni. Esistono fattori di rischio ben precisi per lo sviluppo di miopatia durante la terapia con statine. Tra questi bisogna considerare: età avanzata, alcolismo, bassa statura, insufficienza renale cronica, patologie epatiche, diabete ed ipotiroidismo. Sfortunatamente, alcuni di questi fattori di rischio contribuiscono alle indicazioni per le quali i farmaci ipocolesterolemizzanti vengono proprio utilizzati. Molte di queste condizioni patologiche si manifestano più frequentemente nelle donne anziane, le quali rappresentano pertanto una categoria di pazienti cui porre particolare attenzione al momento dell’inizio della terapia. Per queste ragioni, nei pazienti ad alto rischio, la terapia con statine dovrebbe essere inizialmente effettuata a bassi dosaggi e dovrebbe essere mantenuta alla minima dose terapeutica in tutti i pazienti. Numerosi farmaci, quando vengono somministrati in combinazione alle statine possono incrementare il rischio di miopatia. Questi includono: niacina, verapamil, amiodarone, ciclosporina, antifungini azolici, macrolidi e soprattutto fibrati (gemfibrozil su tutti). Anche il consumo di grandi quantità di succo di pompelmo può rappresentare un importante fattore di rischio. Tutti i pazienti nei quali viene iniziata la terapia con statine dovrebbero essere avvertiti riguardo la possibilità di sintomi muscolari e indotti a segnalare immediatamente l’eventuale insorgenza di dolore o di debolezza muscolare. La terapia con statine dovrebbe infine essere immediatamente interrotta nel caso di dolore muscolare severo o nel caso di colorazione marrone delle urine. Si raccomanda di controllare i livelli di CPK prima di cominciare una terapia a base di statine, considerando comunque che l’incremento asintomatico dei livelli di CPK è relativamente comune. Misurando i livelli di CPK prima dell’inizio della terapia si può evitare di attribuire erroneamente la sua alterazione alla terapia stessa, nel caso di successivo coinvolgimento muscolare. Non è comunque chiaro cosa si debba fare nell’eventualità in cui i livelli di CPK siano in partenza elevati. Inoltre sembra che questa raccomandazione non sia seguita da tutti i medici. Viene inoltre consigliato di valutare i livelli di TSH prima di iniziare la terapia in quanto un ipotiroidismo non trattato, non soltanto può favorire l’insorgenza di miopatia, ma può di per sé incrementare i livelli di colesterolo. I pazienti dovrebbero essere interrogati riguardo l’insorgenza di sintomi muscolari da 6 a 12 settimane dopo l’inizio della terapia e ad ogni visita successiva. Alcuni medici raccomandano di interrompere la terapia prima di essere sottoposti ad interventi chirurgici maggiori o prima di effettuare attività fisiche molto impegnative. Alcuni medici decidono poi di effettuare controlli periodici dei livelli di CPK, nonostante l’utilità di questa pratica non sia stata ancora del tutto chiarita. I livelli di CPK tendono ad aumentare rapidamente e non gradualmente nella miopatia severa, pertanto risulta improbabile che uno screening possa essere benefico. L’ACC, l’AHA e l’NHLBI, non considerano essenziale infatti effettuare il monitoraggio routinario della CPK nei pazienti che assumono statine ed anzi il monitoraggio continuo della CPK può essere potenzialmente pericoloso poiché può indurre i medici a sospendere l’uso delle statine in pazienti ad elevato rischio di eventi cardiovascolari. È stato inoltre dimostrato che alcuni pazienti possono avere livelli di CPK normali pur manifestando evidenze istologiche di miopatia. Quando un paziente in terapia con statine lamenta dolore o debolezza muscolare, si dovrebbe effettuare una anamnesi accurata per valutare l’eventuale predisposizione alla miopatia, nonché un esame fisico focalizzato a valutare lo stato di debolezza muscolare alla palpazione e manifestazioni coerenti con altre cause di miopatia. Nei pazienti affetti da mialgie che non presentano incremento dei livelli di CPK, la continuazione della terapia alla stessa dose o a dosaggi inferiori può rappresentare un’opzione ragionevole, almeno finché i sintomi siano tollerabili e non progressivi. Nei pazienti ad alto rischio di eventi cardiovascolari questa sembra essere l’opzione più saggia. In alternativa, si può sospendere il farmaco fino alla risoluzione dei sintomi. Si può anche scegliere di sostituire la statina o eventualmente utilizzare un’altra classe di farmaci. Le stesse opzioni valgono anche per i pazienti con incremento dei livelli di CPK da lieve a moderato. Nei casi in cui la terapia venga continuata nonostante l’incremento dei livelli di CPK, i pazienti dovrebbero sapere che se compaiono urine scure o se i sintomi peggiorano la somministrazione del farmaco deve essere immediatamente interrotta. I disturbi muscolari associati all’uso di statine generalmente si risolvono in un periodo compreso da pochi giorni ad alcune settimane dopo la sospensione del farmaco. Nei pazienti con marcato incremento dei livelli di CPK o con mioglobinuria, la terapia dovrebbe essere interrotta il più presto possibile ed il paziente dovrebbe essere controllato per verificare la presenza di insufficienza renale. I pazienti con rabdomiolisi ed insufficienza renale dovrebbero essere ricoverati in ospedale per ulteriori trattamenti. Nei pazienti senza insufficienza renale si può procedere ad una terapia domiciliare fino alla risoluzione dei sintomi. In questi pazienti la ripresa del farmaco dovrebbe essere effettuata su decisione individuale valutando il rapporto rischio/beneficio che la sua risomministrazione può comportare.
Se hai un quesito medico, invia la tua domanda a ilmedicorisponde@newsicilia.it e torna a visitare il nostro giornale Domenica mattina!